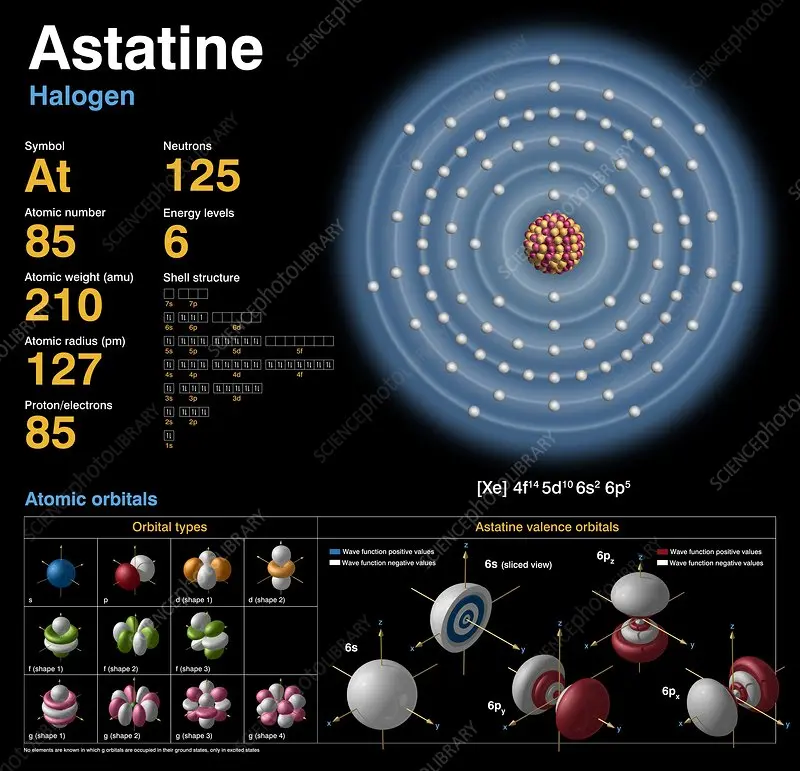
Астат: самый редкий и нестабильный галоген впервые получен в лаборатории
Финскими учеными получено ранее неизвестное ядро 190-астатина. Новый изотоп стал результатом эксперимента, проведенного в Лаборатории ускорителей Университета Ювяскюля, Финляндия. Ядро состоит из 85 протонов и 105 нейтронов и является самым легким изотопом астата, обнаруженным на сегодняшний день. Астат — быстроразлагающийся и очень редкий элемент. Во всей земной коре содержится не более одной столовой ложки астата.
Изотоп — разновидность атомного ядра с одинаковым числом протонов, но разным числом нейтронов. Число протонов определяет химический элемент, а число нейтронов влияет на его массу и стабильность. Например, водород имеет три изотопа: протий (1 протон), дейтерий (1 протон и 1 нейтрон) и тритий (1 протон и 2 нейтрона). Тритий — радиоактивный изотоп водорода, который распадается с периодом полураспада около 12 лет.
Эксперимент по получению нового изотопа астата был проведен с помощью ускорителя частиц — устройства, которое придает высокую скорость заряженным частицам, таким как протоны или ядра атомов. Затем эти частицы сталкиваются с другими атомами или ядрами, вызывая различные ядерные реакции. В данном случае ученые использовали пучок ядер стронция-84, которые бомбардировали мишень из серебра. В результате столкновения образовались новые ядра астата-190 и нейтроны. Эти ядра были отделены от других продуктов реакции с помощью специального детектора — рекойл-сепаратора RITU.
Зачем изучать астат? Астат — самый тяжелый из галогенов — группы элементов, к которой также относятся фтор, хлор, бром и йод. Галогены обладают высокой химической активностью и способностью образовывать соединения с большинством других элементов. Астат интересен тем, что он находится на границе между металлами и неметаллами и может проявлять как металлические, так и неметаллические свойства. Например, астат может быть полупроводником или даже металлом при высоких давлениях. Астат также может образовывать разные степени окисления: -1, +1, +3, +5 и +7. Степень окисления — число, которое показывает, сколько электронов передает или принимает атом при образовании химического соединения.
Изотоп — разновидность атомного ядра с одинаковым числом протонов, но разным числом нейтронов. Число протонов определяет химический элемент, а число нейтронов влияет на его массу и стабильность. Например, водород имеет три изотопа: протий (1 протон), дейтерий (1 протон и 1 нейтрон) и тритий (1 протон и 2 нейтрона). Тритий — радиоактивный изотоп водорода, который распадается с периодом полураспада около 12 лет.
Эксперимент по получению нового изотопа астата был проведен с помощью ускорителя частиц — устройства, которое придает высокую скорость заряженным частицам, таким как протоны или ядра атомов. Затем эти частицы сталкиваются с другими атомами или ядрами, вызывая различные ядерные реакции. В данном случае ученые использовали пучок ядер стронция-84, которые бомбардировали мишень из серебра. В результате столкновения образовались новые ядра астата-190 и нейтроны. Эти ядра были отделены от других продуктов реакции с помощью специального детектора — рекойл-сепаратора RITU.
Зачем изучать астат? Астат — самый тяжелый из галогенов — группы элементов, к которой также относятся фтор, хлор, бром и йод. Галогены обладают высокой химической активностью и способностью образовывать соединения с большинством других элементов. Астат интересен тем, что он находится на границе между металлами и неметаллами и может проявлять как металлические, так и неметаллические свойства. Например, астат может быть полупроводником или даже металлом при высоких давлениях. Астат также может образовывать разные степени окисления: -1, +1, +3, +5 и +7. Степень окисления — число, которое показывает, сколько электронов передает или принимает атом при образовании химического соединения.
Наши новостные каналы
Подписывайтесь и будьте в курсе свежих новостей и важнейших событиях дня.
Рекомендуем для вас

Главная тайна Черного моря разгадана: Ученые рассказали, почему там на дне очень прозрачная пресная вода
Чтобы найти ответ, исследователям пришлось заглянуть на 8 тысяч лет назад...

«Не повторяйте наших ошибок!» 100 лет борьбы с лесными пожарами обернулись катастрофой для США
Эксперты рассказали, почему, казалось бы, проверенная тактика только усугубила ситуацию с лесным огнем...

Секрет 14-го моря России: куда оно пропало и почему о нем снова заговорили?
Эксперты напоминают: Кроме Печорского, у России есть и 15-е «забытое» море, и оно тоже возвращается на карты...

Мегамонстры с 7-го этажа: в древних океанах шла такая война хищников, где у современных косаток не было бы ни единого шанса
Ученые рассказали, куда исчезли «боги» мезозойских морей и почему сейчас их существование было бы невозможно...

Мощнее леса в десятки раз: в ЮАР нашли «живые камни», которые выкачивают CO₂ с бешеной скоростью
Микробиалиты могли бы спасти Землю от потепления, но у этих «каменных насосов» есть один нюанс...
ДНК 4000-летней овцы оказалось ключом к древней тайне, стоившей жизни миллионам
Поразительно, но археологи нашли штамм древней чумы, кошмаривший всю Евразию, в самом таинственном российском городе — Аркаиме. Почему же так получилось?...

Супертелескоп James Webb только запутал ученых, а планета-«близнец» Земли стала еще загадочнее
Эксперты рассказали, почему самый мощный телескоп в истории не смог разобраться с атмосферой TRAPPIST-1e. Аппарат не виноват. Но тогда кто?...

Грядет научный прорыв: Зачем в последние годы ученые по всему миру создают очень странные компьютеры?
Новые аппараты… не просто живые: они стирают различия между ЭВМ и человеческим мозгом...

Новое исследование показало: если бы не этот «российский ген», древние люди вряд ли бы заселили Америку
Ученые рассказали, почему Алтай в ДНК — это главный секрет феноменального здоровья индейцев...
20-летнее наблюдение со спутников «сломало климат»: Теперь ученым придется полностью менять все теории
Зато теперь понятно, почему в двух близких городах могут быть... разные времена года...

Она нам больше не праматерь! Почему легендарную Люси могут «изгнать» из числа наших предков?
Ведущие антропологи мира схлестнулись в настоящей войне. Кто же окажется победителем?...

Еще один страх для авиапассажиров: космические лучи могут вызвать внезапное падение самолета
Эксперты подтверждают: предсказать такие катастрофы практически невозможно. Что же теперь делать?...

3500-летние рисунки на камнях российского острова Вайгач грозят переписать древнюю историю Арктики
Ученые рассказали, кем были мореходы из забытой цивилизации Русского Севера...